

文章来源:中华检验医学杂志, 2021,44(10) : 908-913发布时间:2021年11月11日浏览量:10716次
字体:
大
中
小
常用血栓与止血项目广泛用于出血性疾病诊断、术前筛查、血栓及血栓前状态的判断及抗凝、溶栓药物的监测等。常用血栓与止血项目的检测结果受试剂批次变更影响,而如何进行试剂批次变更的验证、如何识别并判断试剂批次变更导致的检测误差是否在实验室可接受范围,尚无统一标准。中华医学会检验医学分会组织国内同领域专家对上述问题进行了讨论并撰写了指南,以规范常用血栓与止血项目检测试剂批次变更的验证程序。
试剂批次变更时,原材料成分改变、运输和储存不当等原因可引起试剂性能的改变,从而导致临床标本或质控物的检测结果出现偏差,因此对批次变更后的试剂实施有效验证对于保证检测结果的可靠性尤为重要。本指南根据中华人民共和国卫生行业标准、中国合格评定国家认可委员会及美国临床和实验室标准协会等文件要求[1, 2, 3],由中华医学会检验医学分会发起,国内同领域专家撰写和审阅,制定常用血栓与止血项目检测试剂批次变更的验证程序,以规范操作流程,判断试剂批次变更导致的检测误差是否在实验室可接受范围内。
本指南由项目发起专家组、执笔专家组和评议专家组共同完成。项目发起专家组提出撰写意义和写作提纲;执笔专家组撰写指南并根据评审专家意见进行修改。评议专家组对指南撰写意义、写作提纲、文稿进行评议、讨论和修改。
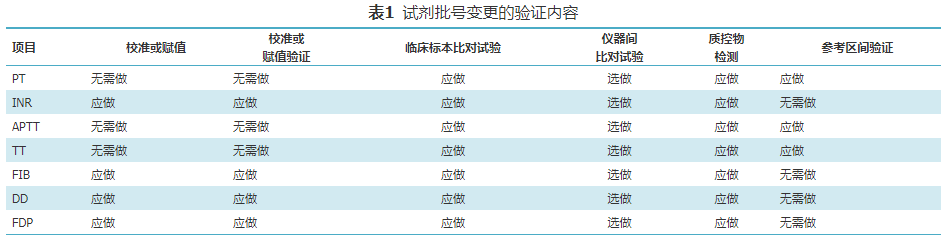
本指南规范了血浆凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、凝血酶时间(thrombin time,TT)、D-二聚体(D-dimer,DD)和纤维蛋白(原)降解产物(fibrin/fibrinogen degradation products,FDP)等6个项目检测试剂批次变更的验证程序,适用于血浆凝固法(全自动凝血分析仪)测定的PT、APTT和TT,Clauss法测定的FIB,微粒凝集定量法测定的DD和FDP。
术语和定义
术语和定义
可比性:使用不同的测量程序测定某种分析物获得的检测结果间的一致性。结果间的差异不超过规定的可接受标准时,为结果具有可比性[4]。
临界差值(critical
difference,CD):当试剂批次变更时,同一标本使用在用和待用批次试剂测定所得的结果之间的最大可接受差异(不影响临床诊疗决策),称为临界差值,即医学允许误差,以标准偏差(SD)或变异系数(CV)表示[3]。
拒绝限:在选定的统计功效下,判断批次间比对的平均偏差的可接受标准,以临界差值的倍数表示[3]。
测量精密度:在规定条件下,对同一或类似被测对象重复测量所得示值或测得值间的一致程度,也称为精密度。以不精密程度表示,如在规定测量条件下的标准偏差或变异系数等[5]。测量精密度包含测量重复性(Sr)和试剂批内精密度(SWRL)。
测量重复性:简称重复性,指在相同地点,由相同操作者在相同测量系统、相同操作条件下,采用相同测量程序、在短时间内对同一或类似被测对象进行重复测量,得到的测量精密度,用Sr表示[5]。
试剂批次内精密度:指在相同地点,使用相同测量系统、相同批次试剂条件下,采用相同测量程序、在一个较长时间内对同一或类似被测对象进行重复测量,得到的测量精密度,属于期间精密度的一种,用SWRL表示[3]。
测量区间:在规定条件下,由具有不确定度的检测仪器或检测系统测定出的一组同类量的量值[5]。
校准验证:采用与临床标本相同的检测仪器测定校准验证物质或已知浓度的标本,以证实该仪器的校准是否在可接受范围内,如在可接受范围内则视为验证通过。
试剂批次变更验证的总则
试剂批次变更验证的总则
试剂批次变更包括试剂批号变更和试剂货运号变更。试剂批号变更是指实验室接收了与上一批是相同生产厂家、相同检测原理、不同生产批号的新试剂。试剂货运号变更是指实验室接收了与上一批是相同批号、不同货运号的新试剂。实验室应在新批次试剂使用前完成验证工作。试剂批次变更验证的流程见图1。
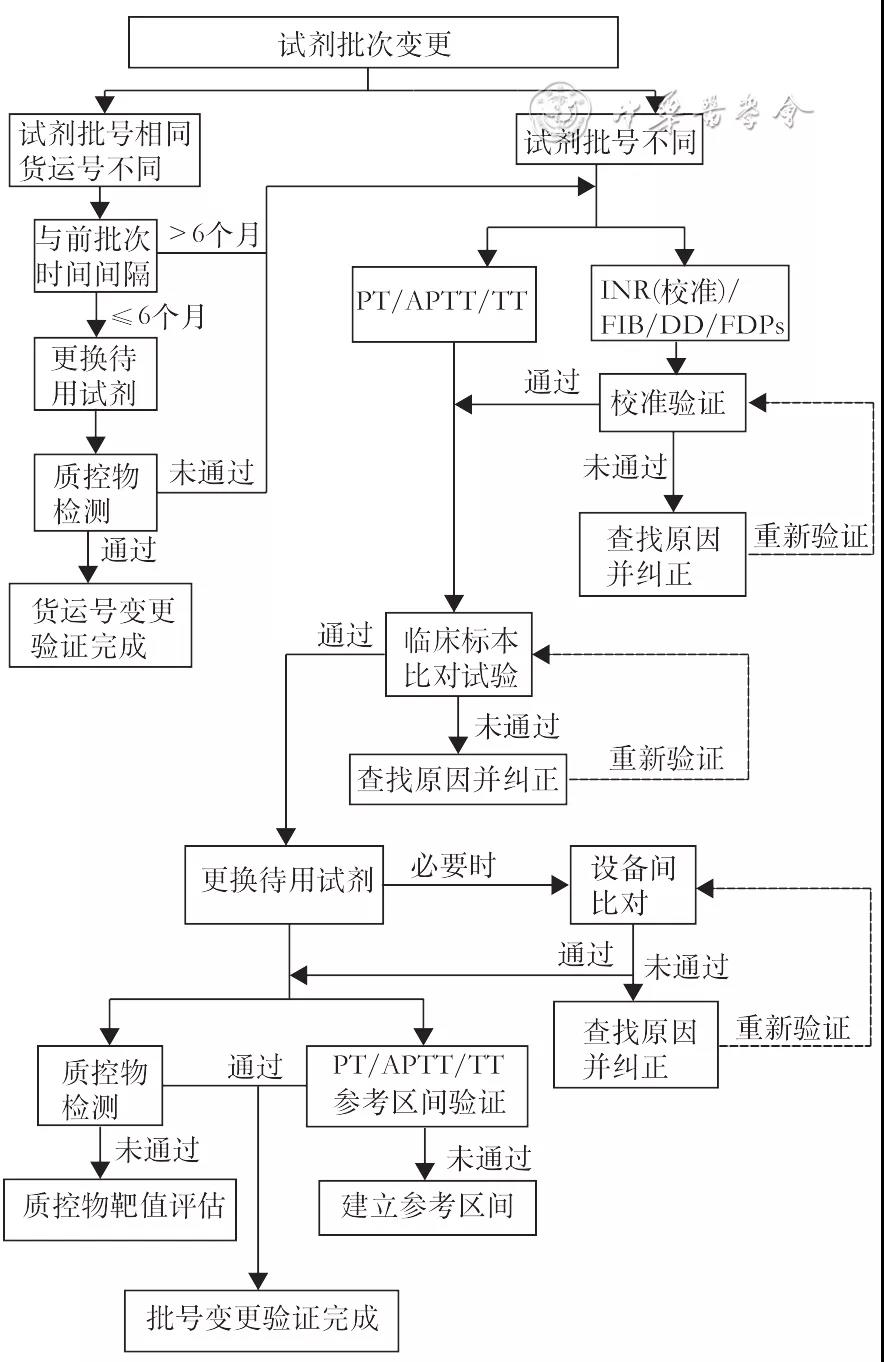
图1 试剂批次变更验证程序流程图
一、试剂批号变更的验证内容
试剂批号变更时,使用校准曲线的项目如FIB、DD和FDP,应进行待用批号试剂的项目校准(预定标除外),并进行校准验证。INR应视制造商要求进行项目校准或赋值,并进行验证。常用血栓与止血项目均应进行临床标本比对试验;临床标本比对试验通过后,应进行质控物检测;PT、APTT和TT应进行参考区间验证。验证内容见表1。
同一实验室使用多台相同检测仪器时,若待用试剂的批号及货运号均相同,应至少在一个检测地点的一台仪器上执行试剂批号变更验证程序,对于其他检测仪器,应通过质控物检测进行结果一致性确认,校准或赋值验证后的项目如INR、FIB、DD、FDP宜采用待用批号试剂进行仪器间比对试验。
二、试剂货运号变更的验证内容
若待用与在用货运号试剂运抵实验室的时间间隔≤6个月,可使用质控物检测的方式确认待用货运号试剂是否可接受,质控物检测未通过时则需进行临床标本比对试验;若两个货运号试剂运抵实验室的时间间隔>6个月,应执行试剂批号变更验证程序。
三、用于试剂批次变更验证的临床标本的总体要求
1.用于试剂批次变更验证的临床标本首选3.2%枸橼酸钠抗凝的新鲜静脉血标本,标本的采集及处理参照《血浆凝固实验血液标本的采集及处理指南》进行[6]。
2.标本应无乳糜、黄疸及溶血等现象,血细胞比容应在20%~55%范围内。
3.标本体积应同时满足在用和待用试剂的验证需求,若单个标本的血浆体积达不到验证所需,可采用两个或两个以上标本的血浆均匀混合后作为验证标本,混合标本的检测结果应加以标识,数量不超过标本总数的20%。
四、项目校准及验证
FIB、DD和FDP试剂批次变更时,实验室应按照仪器及试剂制造商要求完成项目校准或预定标,并进行校准验证。校准验证不通过时,需分析原因并纠正,再执行校准及校准验证程序。
(一)校准验证物质的选择
1.参考物质或其他定值物质,包括但不限于:(1)已赋值的一级、二级标准品或参考物质;(2)室间质评物;(3)试剂制造商提供的用于校准验证的物质或另一批号校准品;(4)试剂使用说明书推荐的适用于校准验证的第三方互换性参考物质。
2.临床标本:商品化校准验证物质无法获得时,推荐使用临床标本进行校准验证。
(二)使用校准验证物质的校准验证方案
1.至少使用5份商品化校准验证物质,含2个或以上水平,浓度应覆盖线性范围,并包含医学决定水平。
2.按照校准验证物质的使用说明书操作,使用待用批次试剂进行单次检测。
3.计算每份标本检测结果与靶值(公议值或所赋参考值)的相对偏差。
(三)使用临床标本的校准验证方案
1.选择在用试剂已测定的标本至少5例,标本水平应覆盖线性范围,包括医学决定水平。
2.在4 h内完成在用批号和待用批号试剂对标本的单次检测。
3.计算待用和在用批号间标本检测结果的相对偏差:
相对偏差(% bi)=(待用批次结果-在用批次结果i)×100/在用批次结果i
(四)结果判读
1.校准验证以总误差作为评价指标,用相对偏差表示。实验室可自行制定校准验证标准,至少应满足表2要求。

2.结果判读:≥80%标本测量结果的相对偏差应满足校准验证标准要求(表2)。
建议1
FIB、DD和FDP试剂批号变更时,实验室应按照仪器及试剂制造商要求完成项目校准或预定标,并进行校准验证。
建议2 推荐使用临床标本进行校准验证。
五、INR校准(或赋值)及校准(或赋值)验证[7]
(一)INR校准(或赋值)方案
PT试剂批号变更时,实验室应根据制造商要求,选择相应的方式对待用批号试剂进行INR校准或赋值。校准(或赋值)验证不通过时,需分析原因并纠正,再执行校准(或赋值)及验证程序。
1.INR校准:采用INR校准品建立PT/INR校准曲线,根据待测标本的PT测定值,通过PT/INR校准曲线计算对应的INR值。
2.INR赋值:使用公式INR=(患者PT值÷健康人平均PT值)ISI进行INR赋值。
ISI的来源:ISI可使用待用批号试剂说明书的赋值,也可使用商品化确认血浆(厂家提供)进行校准,从而获得本室的特定ISI值。
健康人平均PT值的建立:实验室应至少检测20例表观健康人标本的PT值,计算其几何均值作为MNPT值。
(二)INR校准(或赋值)验证物质的选择
实验室可按照以下顺序确定INR校准(或赋值)验证物质:(1)商品化确认血浆:由厂家提供,赋有INR参考值;(2)另一批号INR校准品:由厂家提供,赋有INR参考值;(3)采用在用批号试剂已测定的临床标本。
(三)使用校准验证物质的校准验证方案
1.使用至少3份商品化校准验证物质,覆盖INR正常和(1.5~4.5)范围,并包含医学决定水平。
2.按照校准验证物质的使用说明书操作,使用待用批次试剂对每份标本重复测定2次,重复进行2 d,以排除日间变化。
3.计算每份标本的批内和批间CV,以及均值与所赋参考值的相对偏差。
4.每份INR确认血浆或校准品的批内和批间CV≤10%,检测均值在所赋参考值的±15%内。
(四)使用临床标本的校准验证方案
1.选择在用批次试剂已测定的标本至少5份,标本水平应覆盖INR正常和(1.5~4.5)范围,并包含医学决定水平。
2.验证程序参考“四、项目校准及验证:(三)使用临床标本的校准验证方案”。
3.结果判读参考“四、项目校准及验证:(四)结果判读”。
建议3
PT试剂批号变更时,实验室应按照制造商要求完成INR校准(或赋值),并进行校准(或赋值)验证。
六、临床标本比对试验[3]
试剂批号变更时,常用血栓与止血项目均应进行临床标本比对试验,试验流程参见图2。
图2 临床标本比对试验的流程
(一)比对参数的确定
实验室应首先确定用于比对试验的目标检测水平,确定每一目标水平的CD、测量精密度(Sr、SWRL)和预计统计功效,查询文献[3]里的对应表格得到该目标水平的拒绝限及验证所需的标本数量。
1.目标检测水平的确定:(1)待测标本的目标检测水平应至少包含正常水平和异常水平,并包含医学决定水平。可参照质控物的水平设定验证标本的目标检测水平。对于具有多个医学决定水平的项目,或实验室需要验证其他测量区间的性能变化时,建议增加目标检测水平。(2)可根据(但不限于)目标检测水平×(1±20%)作为选择待验证标本的数值范围。
2.CD的确定:CD与检测系统和目标检测水平有关,实验室可按照美国临床和实验室标准协会
EP26-A要求确定各项目批次间的CD,常用血栓与止血项目检测试剂批次间的CD允许范围见表3。
3.测量精密度的确定:实验室可通过以下方式确定各项目在不同检测水平的测量重复性(Sr)和试剂批次内精密度(SWRL):(1)试剂制造商提供的使用说明书;(2)室内质控数据:在试剂及质控物批号均未改变的情况下,实验室内一定时期(≥20个工作日)在控质控数据的期间测量精密度,即SWRL;(3)精密度试验:可参照行业标准《临床血液学检验常规项目分析质量要求》和《D-二聚体定量检测》实施[8, 9]。其中,Sr对应行业标准中的批内精密度;SWRL对应行业标准中使用单个试剂批次时的日间精密度。
4.预计统计功效的确定:统计功效的选择主要取决于待评估项目检测结果的变化对医疗决策的影响程度。若待评估项目的单个结果变化可能会影响医疗决策,统计功效宜选择0.900或0.950;若待评估项目的单个结果变化对医疗决策不会产生实质性影响,统计功效建议不低于0.800。
(二)临床标本的选择
1.计算每个目标水平对应的CD/SWRL和Sr/SWRL比值。
2.根据目标检测水平的个数,选择要查询的文献[3]里的对应表格。
3.查询文献[3]里的对应表格时,根据CD/SWRL和Sr/SWRL比值所在位置确定标本例数(假阴性率,统计效能)的查询位置,按拒绝限由大到小的顺序,选取统计效能≥选定的统计功效,且假阴性率≤0.05时对应的首个标本例数和拒绝限。
4.当实测值与表中的CD/SWRL和Sr/SWRL比值不一致时,应选择小于实测值最接近的表中所示值,以确保实际得到的统计功效优于表中所示统计效能;当CD/SWRL超出表中最大所示值,应选择验证所需的标本量为1,拒绝限可选择0.7×CD,使统计效能接近0.9;如按上述步骤得到验证所需标本量极大并难以实施、或统计效能过低、或无法查到可用数据,应评估Sr和SWRL数值,必要时加大CD值。
5.最终标本总数不应少于5例,宜覆盖不同浓度。
1.根据“六、临床标本比对试验:(二)临床标本的选择”收集新鲜标本。
2.确认仪器运行状态正常,在用批号试剂的质控结果在控。
3.待用批号试剂完成项目校准后,在4 h内完成在用批号和待用批号试剂对验证标本的单次检测。
4. 计算单个标本的试剂批号间偏差和同一目标水平的试剂批号间平均偏差。
(1)单个标本的试剂批号间偏差:
偏差(bi)=待用批号结果-在用批号结果i
(2)同一目标水平的试剂批号间平均偏差:
平均偏差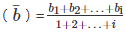
(四)结果判读
1.同一目标水平的每个标本的偏差(bi)与拒绝限的比较:(1)若所有标本的bi均<拒绝限,且不存在同向偏移,则单个标本比对通过;(2)若某一标本bi>拒绝限,需进一步比较bi与同一目标水平其他标本的偏差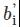 ,若bi>
,若bi>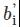 ,应再选择1例该水平范围的标本重新验证;(3)若新标本的bi<拒绝限,应以此替换第一次未通过验证的标本数据;若新标本的bi>拒绝限,需查找原因并纠正;(4)若同一目标水平的偏差存在同向偏移,应警惕系统误差,需查找原因,纠正后重新验证。
,应再选择1例该水平范围的标本重新验证;(3)若新标本的bi<拒绝限,应以此替换第一次未通过验证的标本数据;若新标本的bi>拒绝限,需查找原因并纠正;(4)若同一目标水平的偏差存在同向偏移,应警惕系统误差,需查找原因,纠正后重新验证。
2.同一目标水平的平均偏差的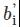 绝对值与拒绝限的比较:
绝对值与拒绝限的比较:
(1)若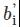 <拒绝限,则该试剂的批次间验证通过。
<拒绝限,则该试剂的批次间验证通过。
(2)若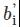 ≥拒绝限,应查找并纠正原因后再次验证,若批号间差异仍存在,需查找原因并纠正。
≥拒绝限,应查找并纠正原因后再次验证,若批号间差异仍存在,需查找原因并纠正。
建议4 实验室应选定待验证标本的目标检测水平,确定每一目标水平的CD、检测不精密度(Sr、SWRL)和预计统计功效,查询文献[3]里的对应表格得到该目标水平的拒绝限及验证所需的标本数量。将上述参数制成表格,在检测系统未发生变化时,用于试剂批号变更时的临床标本比对试验。
七、仪器间比对试验
当实验室有多台相同检测仪器时,校准或赋值验证后的项目宜进行仪器间比对。仪器间比对不通过时,需分析原因并纠正后再次进行仪器间比对。推荐使用临床标本进行仪器间比对试验,标本数≥5;目标水平应覆盖线性范围,包括医学决定水平;在4 h内完成靶机和比对仪器的单次检测。结果 判读可参考“四、项目校准及验证:(四)结果判读”。
八、质控物检测
确认仪器运行状态正常,在用批次试剂的质控结果在控。使用待用批次试剂进行质控物检测,至少包括正常和异常2个水平。若质控物结果在控,则为质控物检测通过;若临床标本比对试验通过,而质控物检测未通过时,实验室需在试剂批次变更后进行室内质控靶值适用性评估,必要时进行质控靶值的累积和调整。
建议5 临床标本比对试验通过,而质控物检测未通过时,实验室需在待用批号试剂使用后,评估室内质控靶值的适用性,必要时进行靶值累积和调整。
九、参考区间验证[2,10]
更换试剂批号时,如在用和待用试剂敏感度差异明显(例如PT、APTT等),应至少收集20份表观健康人的新鲜标本进行参考区间验证;如试剂敏感度接近(例如TT等),可使用至少5份表观健康人标本进行结果比对,以确认参考区间的适用性。若验证未通过,实验室应重新检查分析程序,必要时重新建立参考区间。
执笔人:
寿玮龄(中国医学科学院北京协和医院检验科),吴卫(中国医学科学院北京协和医院检验科),高佳(中国医学科学院肿瘤医院检验科),李传保(北京医院检验科),张洋(中国医学科学院阜外医院实验诊断中心)
专家组成员(按照姓名拼音排序):
阿祥仁(青海省人民医院医学检验科),陈要朋(解放军联勤保障部队第九二三医院输血医学科),崔巍(中国医学科学院肿瘤医院检验科),戴菁(上海交通大学附属瑞金医院检验科),邓新立(解放军总医院第二医学中心检验科),杜彦丹(内蒙古林业总医院检验科),樊爱琳(西安秦皇医院医学检验中心),高辉(昆明医科大学附属延安医院医学检验科),高佳(中国医学科学院肿瘤医院检验科),高岚(河南省人民医院检验科),韩呈武(中日友好医院检验科),江虹(四川大学华西医院实验医学科),李莉(上海市第一人民医院检验医学中心),李强(南方医科大学南方医院检验科),李传保(北京医院检验科),李绵洋(解放军总医院第一医学中心检验科),李子安(青海省人民医院医学检验科),卢佩佩(新疆维吾尔自治区人民医院临床检验中心),乔蕊(北京大学第三医院检验科),屈晨雪(北京大学第一医院检验科),曲琳琳(吉林大学第一医院检验科),沈薇(上海交通大学医学院附属仁济医院检验科),寿玮龄(中国医学科学院北京协和医院检验科),宋鉴清(中国医科大学附属第一医院检验科),孙鹭(云南省第一人民医院检验科,云南省临床检验中心),汤兆明(华中科技大学同济医学院附属协和医院检验科),唐宁(华中科技大学同济医学院附属同济医院检验科),王蓓丽(复旦大学附属中山医院检验科),王成彬(解放军总医院第一医学中心检验科),王梅华(福建医科大学附属协和医院检验科),王明山(温州医科大学附属第一医院医学检验中心),王小中(南昌大学第二附属医院检验科),王学锋(上海交通大学附属瑞金医院检验科),王玉明(昆明医科大学第二附属医院检验科),吴俊(北京积水潭医院检验医学中心),吴卫(中国医学科学院北京协和医院检验科),伍柏青(江西省人民医院检验科),许俊堂(北京大学人民医院心内科),续薇(吉林大学第一医院检验科),杨军(武汉亚洲心脏病医院检验科),杨学敏(兰州大学第二医院检验医学中心),张磊(西安交通大学第二附属医院检验科),张洋(中国医学科学院阜外医院实验诊断中心),张真路(武汉亚洲心脏病医院检验医学中心),郑磊(南方医科大学南方医院检验医学科),周静(四川大学华西医院实验医学科),周洲(中国医学科学院阜外医院实验诊断中心)
参考文献(略)